
A grafita é uma exceção em relação aos outros compostos covalentes, quando se trata da propriedade de conduzir corrente elétrica
Os compostos covalentes, também denominado compostos moleculares, são aqueles que possuem exclusivamente ligações covalentes. Alguns exemplos são:
Água Gás carbônico
H ─ O ─ H O ═ C ═ O
H ─ O ─ H O ═ C ═ O
Algumas características e propriedades desses compostos são explanadas abaixo:
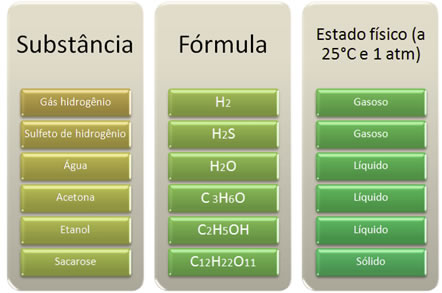
- Estados Físicos: os compostos covalentes podem ser encontrados nos três estados físicos à temperatura ambiente, conforme mostra o quadro abaixo. Porém, em razão de suas moléculas se atraírem menos intensamente, os compostos covalentes são, em geral, gases ou líquidos. Observe também, no quadro, que quanto maior a massa molar e quanto mais intensas forem as forças intermoleculares, maior será a tendência para o composto ser sólido em temperatura ambiente.
- Polaridade: existem compostos covalentes tanto polares como apolares. O que irá determinar sua polaridade será a diferença de eletronegatividade entre os átomos envolvidos na ligação covalente. Se houver diferença de eletronegatividade, significa que o composto será polar; mas se não houver diferença de eletronegatividade entre os átomos, não haverá deslocamento de carga na molécula e esse composto será apolar;
- Pontos de fusão e ebulição: pelo fato de apresentarem baixa atração entre suas moléculas, a energia necessária para separá-las e fazê-las mudar de estado de agregação é pequena, por isso seus pontos de ebulição e de fusão são inferiores aos das substâncias iônicas. Esse fato também varia proporcionalmente com a massa molar e as forças de intermoleculares dos compostos, ou seja, com o aumento da massa molar e da intensidade das forças intermoleculares, os pontos de fusão e de ebulição aumentam e vice-versa.
- Condutividade Elétrica: na sua forma pura, a maioria das substâncias covalentes não conduz corrente elétrica, isto é, comporta-se como isolante. Uma exceção é a grafita, que conduz corrente elétrica por possuir ressonância nos elétrons de sua ligação dupla;
- Solubilidade: a solubilidade desses compostos em água e em outros solventes, como o álcool e o querosene, é bastante variada. Isso se dá porque, conforme já dito, existem compostos moleculares polares e apolares. De modo que os polares se dissolvem em compostos também polares e os apolares se dissolvem em substâncias apolares, ou seja, semelhante dissolve semelhante;
- Tenacidade (resistência): baixa tenacidade, sendo sólidos quebradiços

